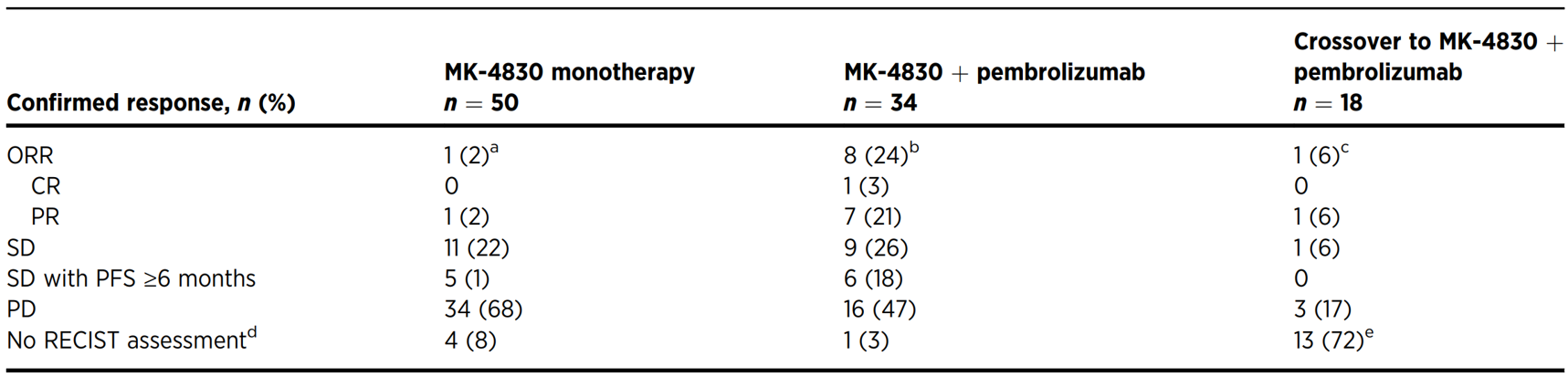
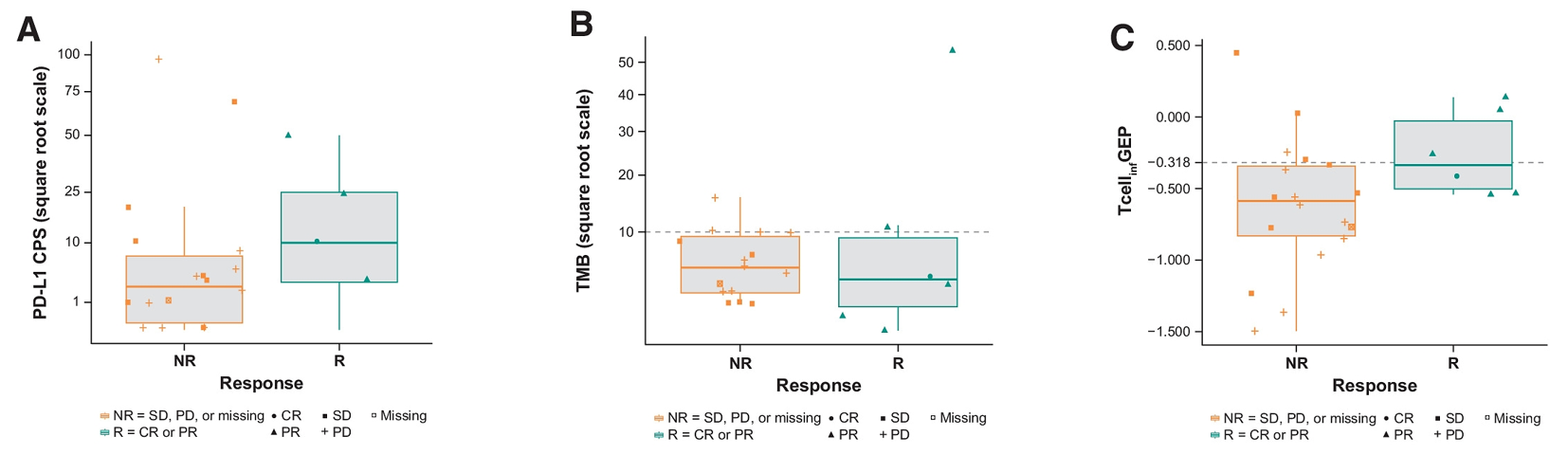
文献标题:First-in-class anti-immunoglobulin-like transcript 4 myeloid-specific antibody MK-4830 abrogates a PD-1 resistance mechanism in patients with advanced solid tumors
影响因子:13.8
文献链接:Clinical Cancer Research 28.1 (2022): 57-70;PMID: 34598945
研究单位:University of Toronto and Merck Inc,加拿大多伦多大学+默克公司