
RNA Biomarker Analysis for Drug Development | Benefits of RNA-Seq
Drug Response RNA Biomarker Discovery and Profiling
因美纳药物开发解决方案

利用CRISPR–Cas9筛选进行癌症治疗靶标优先选择
癌症药物开发过程中存在着多个挑战,其中之一是有效治疗靶标的识别和优先级排序,以提高治疗的临床效果和降低毒性。尽管基因组学技术的发展在一定程度上缓解了这一困境,但仍需要可靠的功能基因组学方法来识别并优先选择癌症治疗靶标。为此来自英国剑桥大学等科研机构的科研人员运用了CRISPR–Cas9筛选技术在多种癌细胞系中进行大规模基因筛选,并建立了一套数据驱动的优先级排序框架,为癌症治疗靶标的系统性选择提供了新的资源和方法。相关研究以题《Prioritization of cancer therapeutic targets using CRISPR–Cas9 screens》的论文发表在了世界级顶刊Nature(IF=50.5)上。

研究背景
癌症药物开发过程中面临的一个重大挑战是识别和优先选择有效的治疗靶标。尽管肿瘤分子特征引导的靶向治疗在提高疗效和减轻毒副作用方面显示了潜力,但由于缺乏足够可靠的候选靶标,大多数患者仍未能从中受益。常见问题包括未能识别出有效的靶标以及现有药物的临床疗效有限。事实上,癌症药物开发的失败率高达90%,其中很大一部分原因是对新靶标的了解有限以及靶标选择不当。
功能基因组学方法在识别癌症靶标方面显示出重要潜力。CRISPR–Cas9基因编辑技术作为一种强大且高效的工具,通过使用单克隆向导RNA(sgRNA)靶向特定DNA序列,以高效、特异地敲除或编辑目标基因,揭示其在细胞生存和生长中的作用。然而,如何系统地分析和优先选择这些基因作为癌症治疗的靶标仍然是一个重要的研究课题。
为了解决这一问题,研究者们借助CRISPR–Cas9筛选技术,通过单克隆向导RNA(sgRNA)库,进行基因功能分析,并探索其在细胞存活和生长中的作用。
样本来源及方法
研究者们选择了来自30种不同的癌症、19种不同的组织的324种人类癌细胞系,并使用Illumina HiSeqTM 2000平台(仅供研究使用,不得用于诊断)对这些癌细胞进行高通量测序,然后对测序得到的18009个基因进行了共计941次的CRISPR–Cas9基因筛选,在数据分析中使用了Adaptive Daisy Model (ADaM) R包来区分环境特异性与核心适应性基因。通过计算每个基因的目标优先级分数,整合了多条证据线索,包括基因适应性效应、基因变异状态和临床突变频率等。筛选后的基因根据开发小分子和抗体的适用性进行了分类,并对优先靶标进行了追踪验证。
结果
图1 靶标优先选择框架
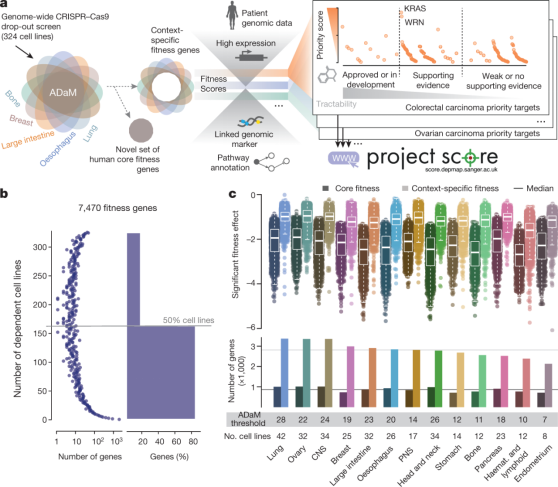
图1a展示了研究者开发的一种多种癌症类型中靶标优先选择的策略,利用Project score数据库和R包ADaM对每个相关基因分配优先级分数。
图1b中,研究者统计了在特定数量的细胞系中表现出适应性缺陷的基因数量,在7470个适应性基因中,多数基因(83%)仅在少数细胞系(小于50%)中产生依赖性。
图1c展示了通过ADaM模型识别出的13种癌症类型中的核心适应性基因和环境特异性适应性基因的数量,两者的中位数分别为866个和2813个。
图2 靶标优先选择和生物标志物发现
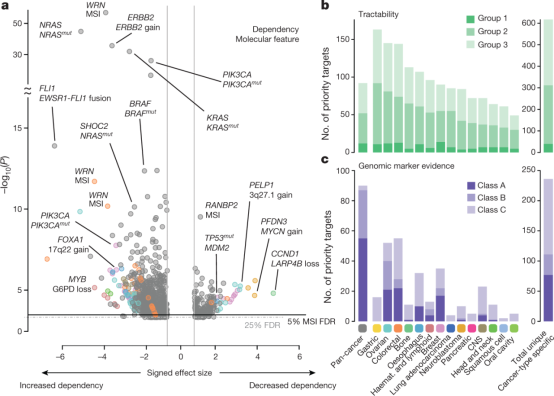
图2a展示了使用ANOVA分析差异依赖性生物标志物,展现了基因与分子特征或微卫星不稳定性(MSI)之间的关联。
图2b展示了基于药物开发可行性分组的癌症类型特异性和泛癌症优先靶标数量,研究共识别了628个独特的优先靶标,其中92个为泛癌症靶标,617个为癌症类型特异性靶标。
图2c展示了不同类别的基因组生物标志物(Class A、B、C)支持的优先靶标数目,泛癌症靶标和胃癌、卵巢癌等癌症的靶标中统计显著性和效应大小最强支持的标志物存在较多,表明这些癌症的相关靶标存在较高的治疗潜力。
图3 优先靶标和生物标志物相关依赖性
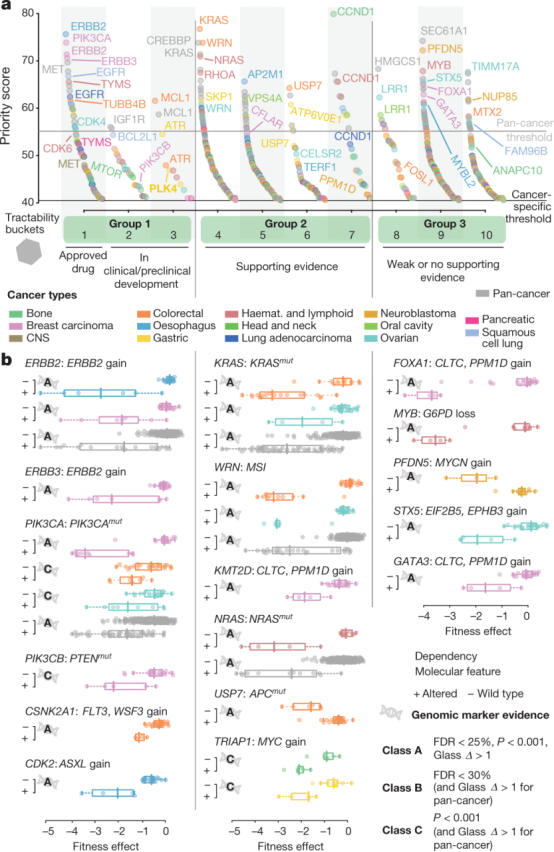
图3a展示了癌症类型特异性和泛癌症优先靶标的可开发性分类。
图3b通过比较含有或不含特定基因组标志物的细胞系,展示了选定优先靶标的差异适应性。其中ERBB2:ERBB2 gain、KRAS:KRASmut、WRN:MSI、PIK3CA:PIK3CAmut呈现明显依赖关系。
图4 癌症类型优先靶标

图4展示了4种癌症的优先靶标分析结果。在结直肠癌中,多个优先靶标被识别出来,包括KRAS、WRN、BCL2L1、PIK3CA等,而卵巢癌的优先靶标有TYMS、CDK4、EGFR、PIK3CA和WRN等。此外,中枢神经系统癌症的优先靶标中CDK4和TEFM有在临床或临床前开发阶段的药物,至于乳腺癌的优先靶标ERBB2和ERBB3则已有获批药物。
图5 WRN在MSI癌细胞中的作用
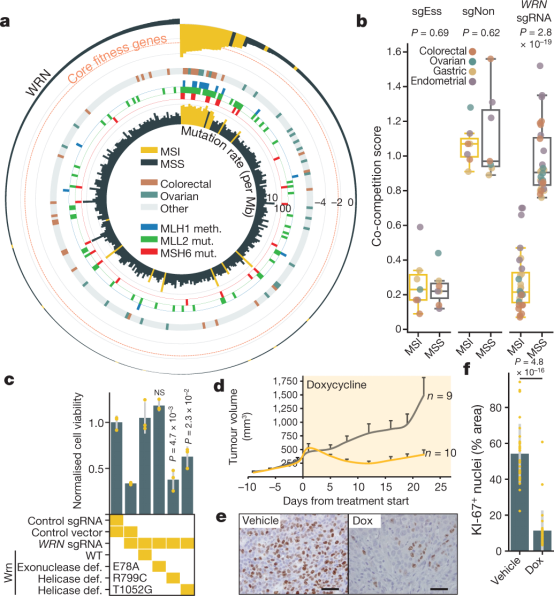
图5a展示了针对多个细胞系的循环图,表明WRN的敲除显著影响了MSI的癌症细胞系,尤其是有MLH1甲基化、MLL2和MSH6突变的癌症类型。
图5b展示了共竞争实验中WRN依赖性的结果,表明WRN敲除后,MSI细胞系的适应性明显降低,而微卫星稳定(MSS)细胞系则无显著变化。
图5c展示了使用野生型(WT)、外切核酸酶缺陷型(E78A)或解旋酶缺陷型(R799C和T1052G)小鼠Wrn基因在MSI细胞(SW48细胞系)中的救援实验结果。WRN敲除后,通过表达野生型或外切核酸酶缺陷型Wrn可以恢复MSI细胞的适应性,而表达解旋酶缺陷型Wrn则无法完全恢复。
图5d展示了在小鼠皮下移植WRN sgRNA表达的HCT116细胞后的肿瘤体积变化,WRN敲除显著抑制了肿瘤的生长,肿瘤体积显著缩小。
图5e展示了多西环素诱导WRN敲除后的HCT116移植肿瘤的KI-67免疫组织化学染色结果,多西环素处理组中肿瘤细胞增殖显著减少。
图5f展示了对KI-67染色的定量结果,多西环素处理组中KI-67阳性细胞的比例显著降低。
总结
本文通过对324种人类癌细胞系进行大规模的CRISPR–Cas9基因筛选,建立了一套系统性的优先级排序框架,这为癌症治疗靶标的识别提供了新的视角。利用这套系统框架,研究人员筛选出了628个优先潜在靶标,并对它们进行了开发适用性评估,尽管这些优先靶标中包括了一些已知的抗癌药物靶点和目前正在临床或临床前开发阶段的靶点,但这项发现仍为药物甄选和再利用提供了新的方向,不仅有助于提高现有药物的开发效率,还能发现新的治疗路径。
其次,研究还发现了WRN基因作为合成致死靶标在具微卫星不稳定性(MSI)肿瘤中的潜力,并证明该发现不仅能通过体内和体外验证得到支持,还为未来的药物开发提供了明确的靶点。尽管WRN的丧失在某些正常细胞中可能引发有害效应,但通过优化患者选择和剂量方案,可以在临床上最大化其治疗效果。与当前已获批的免疫检查点抑制剂联合使用,WRN抑制剂或许能够显著改进MSI患者的治疗方案。
同时,本研究的结果不仅对癌症治疗有深远影响,还可以促进基础生物学研究、基因组工程和疾病遗传学的发展。研究识别出的核心适应性基因和环境特异性基因,作为一个大规模的癌症依赖性基因图谱,对于理解基因在癌症中的功能至关重要。这一资源的开放共享也将为其他研究人员提供宝贵的工具和数据,进一步推动癌症和其他疾病领域的研究进展。
最后,尽管本文的结果令人振奋,但仍需要后续的验证研究来评估所识别靶标的实际临床应用潜力。即使能够略微提升药物开发的成功率,也将对癌症患者带来显著的临床益处。未来的研究应进一步扩展这一框架,结合更多类型的分子数据和临床数据,不断完善和优化靶标优先选择的策略。
总的来说,这项研究通过系统性的方法,显著改进了癌症治疗靶标的识别和优先级排序。研究不仅验证了特定靶标在临床上的潜力,还提出了具有广泛应用前景的框架,为未来的癌症药物开发提供了宝贵的资源和策略。
参考文献

Drug Response RNA Biomarker Discovery and Profiling

The druggable genome and support for target identification and validation in drug development